Voici quelques brèves définitions (sans prétendre à l’exhaustivité) pour mieux comprendre de quoi nous parlons dans l’article et éviter de vous ouvrir des pages Wikipédia en lisant 😀
L’azote est l’ un des nombreux cycles présents dans l’aquarium, car plus ou moins chaque élément en a un: nous avons le cycle du carbone, du phosphore et des autres éléments.
Cependant, surtout pour les conséquences, souvent néfastes, c’est le cycle de l’azote qui a le plus d’influence sur les aquariophiles, même ceux qui l’ignorent (les poissons morts deux à trois semaines après l’insertion voudraient pouvoir le confirmer …).
Puisqu’il s’agit d’un cycle, nous pouvons partir de n’importe quel point: par exemple, de ce que nous mettons dans l’aquarium.
L’azote organique est ce que nous trouvons lié aux atomes de carbone . Nous pouvons le trouver essentiellement à trois endroits:
Cette matière organique se décompose en composants de plus en plus petits, appelés POC (Particulate Organic Carbon – Particle Organic Carbon), jusqu’à ce qu’ils deviennent si petits qu’ils se dissolvent ( DOC – Dissolved Organic Carbon – Dissolved Organic Carbon).
Nous avons probablement tous vu des POC dans les aquariums: c’est le type de vase ou de débris qui se dépose généralement sur le fond, où passent les escargots et autres invertébrés, s’ils sont présents.
Le DOC, cependant, n’est pas visible, sauf son accumulation (non nocive), qui se manifeste par un jaunissement de l’eau.

L’azote organique est immédiatement attaqué par des souches bactériennes hétérotrophes (et d’autres organismes), qui décomposent l’azote organique en composés inorganiques , c’est-à-dire sans carbone. Avec ce processus – appelé minéralisation – il y a généralement la production d’ammoniac (NH 3 ) et de dioxyde de carbone (CO 2 ), en tant que déchets.
Les bactéries responsables de ce processus sont hétérotrophes mais peuvent être à la fois aérobies et anaérobies.
Une première étape du cycle de l’azote est donc la suivante:
Azote organique → Ammoniac + CO 2
Quant à l’ urée seule , les plantes peuvent en absorber directement une partie avant de commencer à se décomposer.
Cependant, une partie de l’azote organique est utilisée par les bactéries elles-mêmes pour leurs structures internes et leur métabolisme.
L’ammoniac est l’un des polluants principaux et les plus dangereux des aquariums.
Il est produit directement par le métabolisme du poisson ou décomposé par des bactéries à partir de composés organiques azotés ou, enfin, inséré comme engrais (généralement sous forme d’ammonium: nitrate d’ammonium, phosphate d’ammonium, etc.).
La toxicité de l’ammoniac dépend principalement du pH de l’ eau, car le pH peut transformer l’ammoniac en ammonium toxique, mais dans une moindre mesure, en ammonium.
La réaction d’équilibre est la suivante:
NH 4 + + OH – ↔ NH 4 OH ↔ NH 3 + H 2 O
ce qui nous indique que l’ ammoniac (NH 3 ) et l’ion ammonium (NH 4 + ) sont toujours présents dans l’eau . Cependant, à mesure que le pH change, nous pouvons pratiquement éliminer la concentration d’ammoniac la plus toxique.
En détail, le pourcentage d’ammoniac diminue à mesure que le pH baisse .
À environ 6,3 pH, l’ammoniac est de 0,1% contre 99,9% d’ammonium.
À mesure que le pH augmente, le pourcentage d’ammoniac augmente rapidement: déjà à pH 8, l’ammoniac dépasse 3% contre 97% d’ammonium.
À pH 9,25, il y a moitié ammoniac et moitié ammonium.
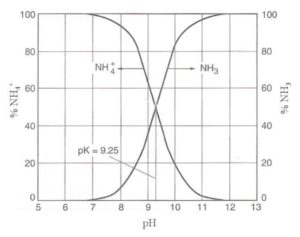
À titre indicatif, il existe une variation des pourcentages d’ordre 10 pour chaque point de pH (et d’ordre 100 tous les deux points et ainsi de suite).
Par exemple, si le pH passe de 8 à 7, la concentration en ammonium passe d’environ 0,33% à 3,3% (et celle de l’ammoniac passe de 99,7% à environ 96,6%).
Soit dit en passant, c’est l’une des raisons pour lesquelles les changements doivent être apportés lentement. Un point de pH peut modifier 10 fois les concentrations d’ammoniac!
L’ammonium et l’ammoniac peuvent être facilement absorbés par les plantes et les algues, s’ils sont présents, et par les bactéries nitrifiantes.
Les plantes et les algues peuvent, en fait, utiliser de l’ammonium comme source d’azote rapidement assimilée, prête à l’emploi immédiatement. En fait, ils ne peuvent pas accumuler d’ammonium pour l’utiliser plus tard.
Comme l’expliquent Diana Walstad et les études qu’elle a citées, l’ammonium est absorbé sous forme d’azote préférentiel par la plupart des plantes.
L’ammonium et l’ammoniac non absorbés par les plantes et les algues sont au contraire traités , par certaines souches bactériennes autotrophes aérobies ( Nitrosomonas et archaea oxydants ammonium), et en nitrites, selon la réaction:
NH 4 + + ½O 2 → 2H + + NO 2 – + H 2 O
Le nitrite dérive de l’oxydation (addition d’oxygène) de l’ammonium et de l’ammoniac et est la première des deux étapes de la nitrification.
Le nitrite est extrêmement toxique (plus que l’ammonium) pour les poissons, car le nitrite a la capacité de se lier à l’hémoglobine contenue dans le sang, empêchant cette dernière de transporter l’oxygène. L’effet est similaire à celui d’un empoisonnement au monoxyde de carbone chez l’homme.
En fait, l’un des principaux effets des faibles concentrations de nitrite est précisément celui des difficultés respiratoires : les poissons qui ont accéléré leur respiration ou qui essaient de respirer à la surface de l’eau, haletant.
Si la concentration de nitrite augmente pendant une durée suffisamment longue, la mort du poisson n’est pas à exclure, au contraire. Je n’ai pas les statistiques sous la main, mais au nez, je dirais que le nitrite est parmi les premières causes de décès dans les aquariums, en particulier dans ceux qui viennent d’être installés.
Le nitrite peut être absorbé par les plantes (des algues dans une moindre mesure si rien, malheureusement il n’y a pas beaucoup d’études à ce sujet), mais la plupart sont convertis en nitrates par d’autres souches bactériennes, toujours aérobies et autotrophes ( Nitrospira ), selon le réaction:
NO 2 – + ½O 2 → NO 3 –
Les nitrates dérivent de l’oxydation des nitrites et sont le résultat de la deuxième des deux étapes qui composent la nitrification.
Ils peuvent également être introduits par divers engrais couramment utilisés, tels que les nitrates de potassium, le calcium, le magnésium, l’ammonium, etc.
Les nitrates ne sont pas toxiques pour les poissons à de faibles concentrations, mais à mesure que la concentration augmente, ils peuvent commencer à poser des problèmes. Problèmes non pas dans le sens où le poisson meurt (contrairement à l’accumulation de nitrite), mais plutôt dans les perturbations de comportement (reproductibilité, activité) et de croissance, également en termes de développement et de coloration des nageoires.
Pour certains poissons, les niveaux de nitrate les plus bas possibles sont conseillés (sinon mesurables, encore meilleurs), tandis que d’autres poissons sont un peu plus tolérants – cela ne signifie pas pour autant qu’ils aiment nager dans les nitrates … Nous y reviendrons plus en détail dans Suivant.
Continuons avec le cycle de l’azote!
Les nitrates sont absorbés par les plantes, ensemble ou à la place de l’ammonium. Pour les plantes, en effet, l’absorption des nitrates est onéreuse car elles doivent la reconvertir en ammonium, afin de pouvoir l’utiliser directement. Cependant, les nitrates sont également importants pour les plantes, car ils peuvent les accumuler dans les tissus pour une utilisation ultérieure (ce qu’ils ne peuvent pas faire avec de l’ammonium).
En plus d’être absorbés par les plantes, les nitrates peuvent être convertis en azote gazeux (N 2 ) par certaines bactéries anaérobies.
Si, en revanche, nous voulions écouter une grande partie des aquariophiles, le seul moyen efficace d’éliminer les nitrates est de faire des changements d’eau , même s’ils ne se résolvent pas toujours (et nous y reviendrons également).
Le cycle de l’azote » modèle classique » dans l’aquarium se terminerait ici, mais ce n’est pas fini!
Il reste encore plusieurs pages d’informations et nous n’avons pas encore évoqué la maturation …
